Rikin fysikaaliset ja kemialliset ominaisuudet
Rikki - melko yleinen luontokemiallinen elementti (16: nnen sisällön maankuoressa ja kuudes luonnollisissa vesissä). On olemassa sekä luonnollista rikkiä (elementin vapaa tila) että sen yhdisteitä.

Rikki luonnossa
Yksi tärkeimmistä rikin luonnollisista mineraaleista,nimi rautapyntit, sphalerite, galena, cinnabar, antimoniitti. Valtamerissä se sisältää pääosin kalsiumin, magnesiumin ja natriumin sulfaatteja, jotka määräävät luonnollisten vesien jäykkyyden.
Miten ne saavat rikkiä?
Rikkihapon uuttaminen suoritetaan eri menetelmillä. Tärkein tapa tuottaa rikki on hajottaa sitä suoraan maahan.

Avoin menetelmä uuttoa vartenkäyttö kaivinkoneet, poistamalla sivukiveä kerroksia, jotka kattavat rikki- malmia. Murskauksen jälkeen malmi sauma murtuu suunnattu niiden seroplavilny kasvi.
Teollisuudessa rikki otetaan sivutuotteeksituoteprosessit uunissa sulatukseen, öljynjalostuksen aikana. Suurissa määrin se on maakaasussa (rikkihapon anhydridin tai rikkivedyn muodossa), jonka uuttamisen aikana se kerrostetaan käytetyn laitteen seinämiin. Kaasusta pyydettyä hienojakoista rikettä käytetään kemianteollisuudessa raaka-aineena eri tuotteiden tuotannossa.
Tämä aine voidaan saada luonnolliseltarikkidioksidikaasua. Tätä varten käytetään Claus-menetelmää. Se koostuu "rikkihapoista", joissa rikki poistuu kaasusta. Tuloksena on modifioitu rikki, jota käytetään laajasti asfaltin valmistuksessa.
Allotrooppisten rikkipohjaisten modifikaatioiden perusteet
Rikki on luontainen allotropiassa. Suuri määrä allotrooppisia muunnoksia tunnetaan. Tunnetuimpia ovat rhombic (kiteinen), monoclinic (acicular) ja muovi rikki. Ensimmäiset kaksi muutosta ovat pysyviä, kolmas jähmettymisessä muuttuu romahdukseksi.

Rikkiä kuvaavat fysikaaliset ominaisuudet
Ortorombisen (a-S) ja monokliinisten (β-S) modifikaatioiden molekyyleissä on 8 rikkiatomia, jotka yhdistyvät suljettuun sykliin yhdellä kovalenttisella sidoksella.
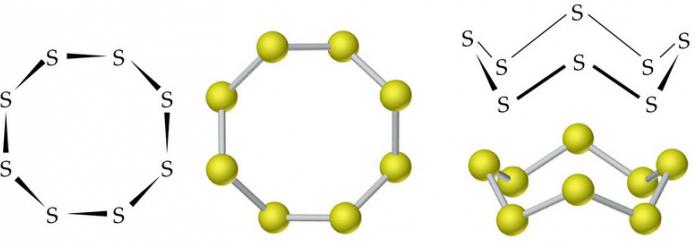
Normaaleissa olosuhteissa rikillä on romahduksellinen modifikaatio. Se on keltainen kiinteä kiteinen aine, tiheys 2,07 g / cm3. Se sulaa 113 ° C: ssa. Monokliinisen rikkien tiheys on 1,96 g / cm3, sen sulamispiste on 119,3 ° C.
Sulatettaessa rikki lisää tilavuus - jamuuttuu keltaiseksi nesteeksi, joka repeytyy 160 ° C: n lämpötilassa ja muuttuu viskoosiseksi tummanruskeaksi massaksi, kun se saavuttaa noin 190 ° C. Tämän arvon ylittävillä lämpötiloilla rikin viskositeetti vähenee. Noin 300 ° C: ssa se muuttuu taas nestemäiseksi virtaavaksi tilaksi. Tämä selittyy sillä, että lämmityksen aikana rikki polymeroituu lisäämällä ketjun pituutta kasvavalla lämpötilalla. Ja kun lämpötila ylittää 190 ° C, polymeeriyksiköt tuhoutuvat.

Kun rikki sulaa jäähdytetään luonnollisestisylinterimäisiä upokkaita, muodostuu ns. harmaita timantteja hammastettuja kiteitä, joilla on vääristynyt muoto oktaedralla, jossa on osittain leikatut reunat tai kulmat.
Jos sula aine altistuu teräväksijäähdytys (esimerkiksi kylmän veden avulla), on mahdollista saada muovinen rikki, joka on elastinen kumimainen ruskean tai tummanpunan värinen massa, jonka tiheys on 2,046 g / cm3. Tämä muutos, toisin kuin rombo jamonoklinaalinen, on epästabiili. Vähitellen (muutaman tunnin sisällä) se muuttuu väriksi keltaiseksi, tulee hauras ja muuttuu rombiaksi.
Kun jäädytys rikkihöyryn (erittäin kuuma) nestemäisen typen muodot purpurea sen muutos, joka on stabiili lämpötiloissa alle -80 ° C: ssa
Vesipitoisessa ympäristössä rikki on käytännöllisesti katsoen liukenematonta. Kuitenkin sille on ominaista hyvä liukoisuus orgaanisiin liuottimiin. Huono käytä sähköä ja lämpöä.
Rikin kiehumispiste on 444,6 ° C. Keittoprosessin mukana seuraa oranssinkeltaisten höyryjen vapautuminen, joka koostuu pääasiassa S: stä8, jotka hajoavat myöhemmällä kuumentamisella, jolloin S: n tasapainomuodot muodostuvat6, S4 ja S2. Edelleen kuumentamisen aikana suuret molekyylit hajoavat ja yli 900 asteen lämpötiloissa pareista koostuu oleellisesti vain S-molekyyleistä2, hajoamasta atomeihin 1500 ° C: ssa.
Mitkä ovat rikkien kemialliset ominaisuudet?
Rikki on tyypillinen ei-metalli. Se on kemiallisesti aktiivinen. hapetus-Rikin pelkistävät ominaisuudet ilmenevätsuhteessa elementtien joukkoon. Kuumennettaessa se liitetään helposti käytännöllisesti katsoen kaikkiin elementteihin, mikä selittää sen pakollisen läsnäolon metallisilla malmeilla. Poikkeukset ovat Pt, Au, I2, N2 ja inerttejä kaasuja. Hapetuksen aste, joka osoittaa rikkiyhdisteitä yhdisteissä, -2, +4, +6.
Rikin ja hapen ominaisuudet aiheuttavat palamisen ilmassa. Tämän vuorovaikutuksen tuloksena on rikkipitoisen (SO2) ja rikkihappo (SO3) anhydridit, joita käytetään rikki- ja rikkihapojen tuottamiseen.
Huoneenlämpötilassa rikin pelkistysominaisuudet ilmenevät vain fluorissa, reaktiossa, jossa muodostuu rikkiheksafluoridia:
- S + 3F2 = SF6.
Kuumennettaessa (sulan muodossa) on vuorovaikutuksessa kloorin, fosforin, piin, hiilen kanssa. Vetyä sisältävien reaktioiden seurauksena vetysulfidin lisäksi se muodostaa sulfaatit yhdistettynä yleisellä kaavalla H2SH.
Rikin hapettavia ominaisuuksia havaitaan, kunvuorovaikutus metallien kanssa. Joissakin tapauksissa voimakkaita reaktioita voidaan havaita. Metallien kanssa tapahtuvan vuorovaikutuksen seurauksena muodostuu sulfideja (rikkiyhdisteitä) ja polysulfideja (monikerrosmetalleja).
Pitkäaikainen lämmitys reagoi väkevien happojen hapettavien aineiden kanssa hapettaen samalla.
Seuraavaksi tarkastelemme rikkiyhdisteiden pääominaisuuksia.
Rikkidioksidi
Rikki (IV) -oksidi, jota kutsutaan myös rikkidioksidiksija rikkihappoanhydridi, on kaasu (väritön), jähmeällä tukahduttava haju. Sen ominaisuus on nesteytetty paineessa huoneenlämmössä. SO2 on hapan oksidi. Hyvin liukoinen veteen. Tämä tuottaa heikkoa, epävakaata rikkihappoa, joka on olemassa vain vesiliuoksessa. Rikkihappoanhydridin ja emästen välisen vuorovaikutuksen seurauksena muodostuu sulfiitteja.
Eroaa melko korkean kemikaalinaktiivisuutta. Merkittävimmät ovat rikki (IV) -oksidin pelkistävät kemialliset ominaisuudet. Tällaisiin reaktioihin liittyy rikkihapettamisen lisääntyminen.
Rikkioksidin oksidatiiviset kemialliset ominaisuudet ilmenevät voimakkaiden pelkistävien aineiden (esimerkiksi hiilimonoksidin) läsnäollessa.
Rikkitrioksidi
Rikki-trioksidi (rikkianhydridi) on korkein oksidirikki (VI). Normaaleissa olosuhteissa se on väritön, haihtuva neste, jolla on tukahduttava haju. Sillä on jäädytys alle 16,9 astetta. Muodostuu kiinteän rikitrioksidin erilaisten kiteisten modifikaatioiden seos. Rikkioksidin hyvät hygroskooppiset ominaisuudet aiheuttavat sen "savun" kostealla ilmalla. Tuloksena syntyy rikkihapon pisaroita.
Vety- sulfidi
Vety- sulfidi on binäärinen vety- ja rikkiyhdiste. H2S on myrkyllinen, värittömän kaasun ominaispiirrejoiden ominaisuudet ovat makea maku ja murtuneiden munien tuoksu. Se sulaa miinus 86 ° С, kiehuu miinus 60 ° С. Onko termisesti epästabiili. Lämpötila-arvoissa yli 400 ° C, vetysulfidi hajoaa S: ksi ja H: ksi2. Sille on ominaista hyvä liukoisuus etanolissa. Se liukenee huonosti veteen. Liukenemisen seurauksena muodostuu heikkoa vetysulfidia. Vety-sulfidi on voimakas pelkistin.

Syttyvää. Kun se palaa ilmassa, näet sinisen liekin. Korkeissa pitoisuuksissa se pystyy reagoimaan monien metallien kanssa.
Rikkihappo
Rikkihappo (H2SO4) voi olla erilainen pitoisuus ja puhtaus. Vedettömässä tilassa on väritön öljymäinen neste, jolla ei ole hajua.
Lämpötila, jossa ainesulaa, on 10 ° C. Kiehumispiste on 296 ° C. Se liukenee hyvin veteen. Rikkihappoa liuotettaessa muodostuu hydraatteja, ja suuri määrä lämpöä vapautuu. Kaikkien vesiliuosten kiehumispiste paineessa 760 mmHg. Art. ylittää 100 ° С. Kiehumispiste kasvaa happokonsentraation lisäämisellä.

Aineen hapot ominaisuudet ilmenevät, kun ne ovat vuorovaikutuksessa emäksisten oksidien ja emästen kanssa. H2SO4 on kaksiemäksinen happo, jonka seurauksena se voi muodostaa sekä sulfaatit (keskisuolat) että vetysulfaatit (happamat suolat), joista suurin osa on liukoisia veteen.
Rikkihapon merkittävimmät ominaisuudet ilmenevät hapetus-pelkistysreaktioissa. Tämä johtuu siitä, että H: n koostumuksessa2SO4 rikki on korkeampi hapetusaste (+6). Esimerkkinä rikkihapon hapettavien ominaisuuksien ilmentymisestä voidaan mainita reaktio kuparin kanssa:
- Cu + 2H2SO4 = CuSO4 + 2H2O + SO2.
Rikki: hyödyllisiä ominaisuuksia
Rikki on mikroelementti, jota tarvitaaneläviä organismeja. Se on erottamaton osa aminohappoja (metioniini ja kysteiini), entsyymejä ja vitamiineja. Tämä osa osallistuu proteiinin tertiäärisen rakenteen muodostumiseen. Proteiinien sisältämä kemiallisesti sitoutunut rikki on painon perusteella 0,8 - 2,4%. Elementin sisältö ihmiskehossa on noin 2 grammaa painokiloa kohti (eli noin 0,2% on rikkiä).
Mikroelementtien hyödylliset ominaisuudet vaikeutuvatyliarvioida. Veren protoplasman suojaaminen rikki on aktiivinen elimen avustaja haitallisten bakteerien torjunnassa. Koagulaation määrä riippuu sen määrästä, eli elementti ylläpitää riittävää tasoa. Myös rikki on tärkeä rooli ruumiin tuottaman sapen normaalien pitoisuuksien ylläpitämisessä.
Sitä kutsutaan usein kauneuden mineraaliksion yksinkertaisesti välttämätöntä säilyttää ihon, kynsien ja hiusten terveys. Chere on luontainen kyky suojata organismia erilaisista ympäristön negatiivisista vaikutuksista. Tämä auttaa hidastamaan ikääntymisprosessia. Rikki puhdistaa toksiinien rungon ja suojaa säteilyltä, mikä on erityisen totta nyt, kun otetaan huomioon nykyinen ympäristötilanne.
Riittämätön määrä hivenaine elimistössä voi johtaa huonoksi kuonan eroon, vähentää immuniteettia ja elinvoimaa.
Rikki on osallistuja bakteerien fotosynteesiin. Se on bakterioklorofylliinin osa ja vetysulfidi on vetylähde.
Rikki: ominaisuudet ja sovellukset teollisuudessa
Käytetään laajimmin käytettyä rikkiärikkihapon tuotanto. Tämän aineen ominaisuuksien ansiosta sitä voidaan käyttää myös kumin vulkanisoimiseksi maataloudessa ja jopa huumeiden (kolloidirikki) fungisidina. Lisäksi rikkiä käytetään otteluiden ja pyroteknisten yhdisteiden tuottamiseen, se on osa rikki-bitumin koostumuksia rikki-asfaltin valmistukseen.



