Molekyylirakenne on ... Mikä aineella on molekyylirakenne
Kuten tiedetään, kemia tutkii rakennetta ja ominaisuuksiaaineet samoin kuin niiden keskinäiset muutokset. Tärkeä paikka kemiallisten yhdisteiden karakterisoinnissa on kysymys siitä, mistä hiukkasista ne ovat. Se voi olla atomeja, ioneja tai molekyylejä. Kiinteissä aineissa ne tulevat kiderakenteiden solmukkeisiin. Molekyylirakenteessa on suhteellisen pieni määrä yhdisteitä kiinteässä, nestemäisessä ja kaasumaisessa tilassa.
Tässä artikkelissa annamme esimerkkejä aineistajotka on karakterisoitu molekyylikiteiden ristikoilla, ja harkitsevat myös monenlaisia intermolekulaarisia vuorovaikutuksia, jotka ovat ominaisia kiinteille aineille, nesteille ja kaasuille.
Miksi sinun täytyy tietää kemiallisten yhdisteiden rakenne
Jokaisella ihmisen tietämyksellä,erottaa joukko perustavanlaatuisia lakeja, joilla tieteen jatkokehitys perustuu. Kemia on M.V.n teoria. Lomonosov ja J. Dalton, jotka selittävät aineen atomimolekyylirakennetta. Kuten tutkijat ovat todenneet, tietäen sisäisen rakenteen, voimme ennustaa sekä yhdisteen fysikaalisia että kemiallisia ominaisuuksia. Valtava määrä keinotekoisesti syntetisoituja orgaanisia aineita (muoveja, lääkkeitä, torjunta-aineita jne.) On ennalta määrätyt ominaisuudet ja ominaisuudet, jotka ovat arvokkaimpia teollisuuden ja kotitalouksien tarpeisiin.

Tieto rakenteesta ja ominaisuuksistayhteyksiä vaaditaan ohjauskokeiden, kokeiden ja tutkimusten suorittamisessa kemian kurssilla. Esimerkiksi ehdotetussa aineiden luettelossa oikeat vastaukset: millä aineella on molekyylirakenne?
- Sinkkiä.
- Magnesiumoksidi.
- Timantti.
- Naftaleeni.
Oikea vastaus on: sinkin molekyylirakenne sekä naftaleeni.
Intermolekulaariset vuorovaikutusvoimat
On kokeellisesti todettu, että molekyyliRakenne on ominaista aineille, joilla on alhainen sulamispiste ja alhainen kovuus. Kuinka voimme selittää näiden yhdisteiden kidehilojen epävakauden? Kuten kävi ilmi, kaikki riippuu hiukkasten yhteisestä osuudesta niiden solmuissa. Sillä on sähköinen luonne ja sitä kutsutaan intermolekulaariseksi vuorovaikutukseksi tai van der Waals -voimiksi, jotka perustuvat vastakkain varautuneiden dipoliemolekyylien vaikutukseen toisiinsa. Kävi ilmi, että niiden muodostumista on useita mekanismeja riippuen itse aineen luonteesta.
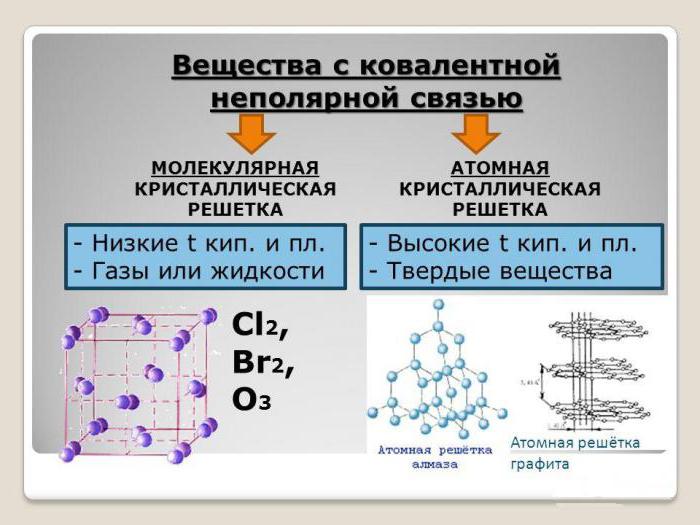
Hapot molekyylikoostumuksen yhdisteinä
Useimpien happojen, sekä orgaanisten,sekä epäorgaaniset että epäorgaaniset, sisältävät polaarisia hiukkasia, jotka on suunnattu suhteessa toisiinsa vastakkain varautuilla napoilla. Esimerkiksi kloridihappo-HCl: n liuoksessa on dipoleja, joiden välillä on orientatiivisia vuorovaikutuksia. Lämpötilan nousu molekyylien kloorivety-, bromivety- (HBr) ja muut halogeeni hapoilla, laskua suuntautumisen vaikutus, koska lämpöliike hiukkasten estää niiden keskinäinen vetovoima. Edellä mainittujen aineiden lisäksi molekyylirakenteessa on sakkaroosia, naftaleenia, etanolia ja muita orgaanisia yhdisteitä.
Miten indusoidut ladatut hiukkaset alkavat
Aikaisemmin pidimme yhtenä toimintamekanismistaVan der Waalsin voimat, joita kutsutaan orientaaliseksi vuorovaikutukseksi. Orgaanisten aineiden ja halogeenipitoisten happojen lisäksi molekyylirakenteessa on vetyoksidivettä. Aineissa, jotka koostuvat ei-polaarisista, mutta alttiita dipolien muodostumiselle, molekyylit, kuten hiilidioksidi CO2, indusoitujen ladattujen hiukkasten - dipolien ulkonäkö on mahdollista tarkkailla. Niiden tärkein ominaisuus on kyky houkutella toisilleen sähköstaattisen vetovoiman vaikutuksen ansiosta.
Kaasun molekyylirakenne
Edellisessä tekstityksessä mainitsimme tämänyhdiste, kuten hiilidioksidi. Jokainen sen atomista luo itsensä ympärille sähkökentän, joka polaaroi atomin läheiselle hiilimolekyylille. Se muunnetaan dipoliin, joka vuorostaan kykenee polaroimaan muita CO-hiukkasia2. Tämän seurauksena molekyylit houkutellaan toisiinsa. Induktiivista vuorovaikutusta voidaan myös havaita aineissa, jotka koostuvat polaarisista hiukkasista, vaikka tässä tapauksessa se on paljon heikompi kuin orientational van der Waals -voimat.

Dispersio-vuorovaikutus
Molemmat atomit itse ja hiukkaset, jotka muodostavat niidenkoostumus (ytimet, elektronit) pystyvät jatkuvasti pyörimään ja värähtelemään. Se johtaa dipolien esiintymiseen. Kvanttimekaniikan tutkimuksen mukaan välittömiä kaksinkertaisesti ladattuja hiukkasia esiintyy sekä kiintoaineissa että nesteissä synkronisesti siten, että vierekkäisten molekyylien päistä muodostuu vastakkaisia napoja. Tämä johtaa niiden sähköstaattiseen vetovoimaan, jota kutsutaan dispergointivaihtoehdoksi. Se on erikoinen kaikille aineille, paitsi kaasumaisessa tilassa olevat aineet, joiden molekyylit ovat monatomisia. Van der Waalsin voimat voivat kuitenkin syntyä esimerkiksi inerttien kaasujen (helium, neon) siirtyessä nestefaasiin alhaisissa lämpötiloissa. Niinpä ruumiiden tai nesteiden molekyylirakenne määrittää niiden kyvyn muodostaa erilaisia molekyylienvälisiä vuorovaikutuksia: orientaatiota, indusoitua tai dispersiivista.
Mikä on sublimaatio?
Kiinteän kappaleen, esimerkiksi jodikiteiden, molekyylirakenne aiheuttaa tällaisen mielenkiintoisen fysikaalisen ilmiön kuin sublimaatio - molekyylien I haihtuminen2 violettihöyryn muodossa. Se tapahtuu kiinteän faasin aineen pinnalta ohittamalla nestemäistä tilaa.

Tämä visuaalisesti tehokas kokemus toteutetaan useinkoulukemian luokkahuoneita havainnollistamaan molekyylikiteiden ristikkorakenteiden rakenteellisia ominaisuuksia ja yhdisteiden niihin liittyviä ominaisuuksia. Yleensä se on alhainen kovuus, alhainen sulamis- ja kiehumispiste, huono lämmön- ja sähkönjohtavuus, haihtuvuus.
Aineiden rakenteen tuntemusta käytännöllisesti
Kuten olemme nähneet, kiteisen tyypin välilläristikko, yhteyden rakenne ja ominaisuudet voivat luoda tietyn korrelaation. Siksi, jos aineen ominaisuudet tunnetaan, on riittävän helppo ennustaa hiukkasten rakenteen ja koostumuksen ominaisuuksia: atomeja, molekyylejä tai ioneja. Saadut tiedot voivat myös olla hyödyllisiä, jos kemikaalitoimissa on välttämätöntä valita yhdisteistä, joilla on molekyylirakenne, ja joka poistaa ne, joilla on atomi- tai ioni-tyyppiset ristikot.
Yhteenvetona voimme tehdä seuraavan päätelmän: molekyylirakenteella on kiinteä runko ja sen kidehila-alueiden spatiaalinen rakenne sekä nesteiden ja kaasujen polarisoitujen hiukkasten järjestelyn erityispiirteet ovat täysin vastuussa sen fysikaalisista ja kemiallisista ominaisuuksista. Teoreettisesti dipolien sisältävien yhdisteiden ominaisuudet riippuvat molekyylienvälisten vuorovaikutusvoimien suuruudesta. Mitä suurempi molekyylien napaisuus ja mitä pienempi atomien säde koostumuksessaan, sitä voimakkaammat ovat niiden väliset suuntausvoimat. Päinvastoin, mitä enemmän molekyylejä muodostavat atomit, sitä suurempi on sen dipoli-hetki, ja siksi merkittävämpiä ovat dispergoivat voimat. Näin ollen kiinteän kappaleen molekyylirakenne vaikuttaa myös vuorovaikutusvoimaan hiukkasten dipoliin.





