Alkeenien ensimmäinen edustaja on eteeni. Fysikaaliset ominaisuudet, tuotanto, etyleenin käyttö
Tyydyttymättömien hiilivetyjen valoisa edustaja -eteeni (eteeni). Fysikaaliset ominaisuudet: värittömät palavat kaasut, räjähtävät happea ja ilmaa sisältävät seokset. Merkittävä määrät eteeniä maaöljystä saadut synteesin myöhemmässä orgaanisten aineiden (yksiarvoiset ja alkoholien, polymeerit, etikkahappoa ja muita yhdisteitä).
Etyleenin homologinen sarja, sp2hybridisaatio

Rakenteeltaan ja ominaisuuksiltaan samankaltaisia hiilivetyjä kutsutaan alkeneiksi. Historiallisesti toinen ryhmään kuuluva termi, olefiinit, oli kiinteä. Yleinen kaava CnH2n heijastaa koko luokan aineita. Sen ensimmäinen edustaja on eteeni, jonka molekyylissä hiiliatomit muodostavat kolme, mutta vain kaksi vetysidettä x-sidosta. Alkenesit - tyydyttymättömät tai tyydyttymättömät yhdisteet, niiden kaava C2H4. Vain 2 p ja 1 sekoitetaan muotoon ja energiaanhiiliatomin s-elektronipilvestä muodostuu yhteensä kolme x-sidosta. Tätä tilaa kutsutaan sp2-hybridisaatioksi. Neljäs hiilen valenssi säilyy, molekyylissä on π-sidos. Rakennekaavassa rakenteellinen ominaisuus heijastuu. Mutta symbolien eri tyyppisten kommunikaatiotyyppien osoittamiseen käytetään yleensä samoja viivoja tai pisteitä. Eteenin rakenne määrittää sen aktiivisen vuorovaikutuksen eri luokkien aineilla. Veden ja muiden hiukkasten lisääminen johtuu heikon π-sidoksen repeämisestä. Vapautuneet valenssit kyllästyvät hapen, vedyn ja halogeenien elektronien ansiosta.
Eteeni: aineen fysikaaliset ominaisuudet
Etene normaaleissa olosuhteissa (normaali ilmakehänpaine ja lämpötila 18 ° C) on väritön kaasu. Se on makea (eteerinen) haju, sen sisäänhengitys vaikuttaa huumeisiin henkilöihin. Koveta -169,5 ° C, sula samojen lämpötilaolosuhteiden vallitessa. Etaani kiehuu -103,8 ° C: ssa. Syttyy, kun se kuumennetaan 540 ° C: seen. Kaasu palovammoja, liekki hehkuu ja heikko noki. Eteeni liukenee eetteriin ja asetoniin, paljon vähemmän veteen ja alkoholiin. Aineen pyöristetty moolimassa on 28 g / mol. Homogeenisen eteeni-sarjan kolmas ja neljäs edustaja ovat myös kaasumaisia aineita. Viidennen ja seuraavan alkeen fysikaaliset ominaisuudet eroavat toisistaan, ne ovat nesteitä ja kiinteitä aineita.
Eteenin valmistus ja ominaisuudet
Saksalainen kemisti Johann Becher käyttäytyi vahingossaEtyylialkoholi kokeissa väkevän rikkihapon kanssa. Tämä oli ensimmäinen kerta, kun eten oli saatu laboratorio-olosuhteissa (1680). XIX vuosisadan puolivälissä A.M. Butlerov antoi yhdis- teelle nimen etyleenin. Fyysiset ominaisuudet ja kemialliset reaktiot on myös kuvannut kuuluisa venäläinen kemisti. Butlerov ehdotti rakennekaavaa, joka heijastaa aineen rakennetta. Menetelmät sen hankkimiseksi laboratoriossa:

- Asetyleenin katalyyttinen hydraus.
- Kloorietaanin dihydrohalogenointi reaktiossa väkevän alkoholipitoisen alkoholiliuoksen kanssa, jossa on vahvaa emästä (alkalia) kuumentamisen jälkeen.
- Veden lohkaiseminen etyylialkoholin molekyyleistä (dehydraatio). Reaktio tapahtuu rikkihapon läsnäollessa. Sen yhtälö on: H2C-CH2-OH → H2C = CH2 + H2O
Teollisuustuotanto:
- öljykäsittely - hiilivetyraaka-aineiden halkeilu ja pyrolyysi;
- etaanin dehydrogenointi katalyytin läsnä ollessa. H3C-CH3 → H2C = CH2 + H2
Eteenin rakenne selittää sen tyypilliset kemialliset reaktiot - hiukkasten lisäämisen C-atomeilla, jotka ovat moninkertaisessa sidoksessa:
- Halogenointi ja hydrohalogenointi. Näiden reaktioiden tuotteet ovat halogenoidut johdannaiset.
- Hydraus (kyllästyminen vedyllä), etaanin tuotanto.
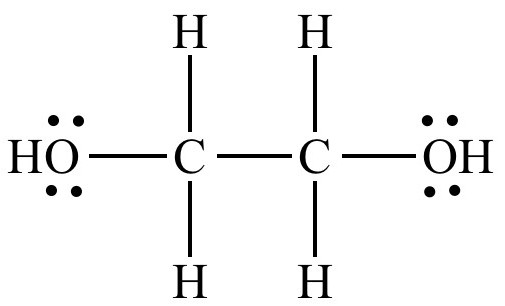
- Hapetus dihydriseksi alkoholietyleeniglykoliksi. Sen kaava: OH-H2C-CH2-OH.
- Polymerointi kaavion mukaan: n (H2C = CH2) → n (-H2C-CH2-).

Eteenin käyttökohteet
Kun öljy jakautuu tislaamalla suuria määriäetyleeniä. Aineen fysikaaliset ominaisuudet, rakenne ja kemiallinen luonne mahdollistavat sen käytön etyylialkoholin, halogenoitujen johdannaisten, alkoholien, oksidin, etikkahapon ja muiden yhdisteiden valmistuksessa. Eteeni on polyetyleenimonomeeri sekä polystyreenin lähtöyhdiste.
Dikloorietaania, joka on saatu etee- nistä ja kloorista,on hyvä liuotin, jota käytetään PVC: n (PVC) valmistuksessa. Alhaisen ja suuren paineen omaava polyeteeni valmistetaan kalvosta, putkista, astioista, polystyreeni-CD-koteloista ja muista yksityiskohdista. PVC on linoleumin, vedenpitävien sadetakkien perusta. Maataloudessa ethenom kohtelee hedelmiä ennen sadonkorjuuta kypsymisen nopeuttamiseksi.