Elektrofiilinen lisäys orgaaniseen kemiaan
Kiinnitysreaktioita karakterisoidaan muodostumallayksi kemiallinen yhdiste kahdesta tai useammasta lähtöaineesta. Harkitse elektrofiilisen lisäyksen mekanismia sopivaksi alkenien esimerkille - tyydyttymättömät asykliset hiilivedyt yhdellä kaksoissidoksella. Näiden lisäksi muut sellaiset hiilivedyt, joissa on useita sidoksia, myös sykliset, tulevat tällaisiin muutoksiin.
Alkuperäisten molekyylien vuorovaikutuksen vaiheet
Elektrofiilinen liittäminen tapahtuu useissavaiheissa. Elektroforeesi, jolla on positiivinen varaus, toimii elektronin vastaanottajana ja alkene- molekyylin kaksoissidoksella on elektronidonori. Molemmat yhdisteet muodostavat ensin epästabiilisen p-kompleksin. Sitten π-kompleksin transformointi ϭ-kompleksiksi alkaa. Karbakoinnin muodostuminen tässä vaiheessa ja sen stabiilisuus määrää koko vuorovaikutuksen nopeuden. Tämän jälkeen karbokationi vuorovaikuttaa nopeasti osittain negatiivisesti varautuneeseen nukleofiiliin ja muodostuu transformaation lopullinen tuote.

Substituenttien vaikutus reaktionopeuteen
Maksun delokalisoituminen (ϭ +) karbokataan riippuualkuperäisen molekyylin rakenteesta. Positiivinen induktiivinen vaikutus, joka ilmenee alkyyliryhmä, johtaa vähenemiseen vastaa viereisen hiiliatomin. Seurauksena, että molekyyli elektroneja luovuttavalla substituentilla lisää suhteellinen vakaus kationin π-elektronitiheys johtuu ja reaktiivisuus koko molekyylin. Elektronin vastaanottajien vaikutus reaktiivisuuteen on vastakkainen.
Halogeeniosuuden mekanismi
Tarkastellaan tarkemmin mekanismi elektrofiilisen lisäyksen alkeenin esimerkki vuorovaikutuksesta ja halogeeni.
- Halogeeni-molekyyli lähestyy kaksoissidostavälillä ja on polarisoitunut. Koska osittain positiivinen varaus molekyylin toisessa päässä, halogeeni vetää π-sidon elektroneja. Näin muodostuu epävakaa π-kompleksi.
- Seuraavassa vaiheessa elektrofiilinen hiukkanen yhdistyy kaksi hiiliatomia muodostamaan sykli. Syklinen "onium" -ioni näkyy.
- Jäljellä oleva haluttu halogeenihiukkas(positiivisesti varautunut nukleofiili) on vuorovaikutuksessa oniumion kanssa ja se on kytketty edellisen halogeenihiukkasten vastakkaiselle puolelle. Lopullinen tuote, trans-1,2-dihalogenalkaani, esiintyy. Samoin halogeenin lisääminen sykloalkeeniksi.
Hydrohalihapon lisäämismenetelmä

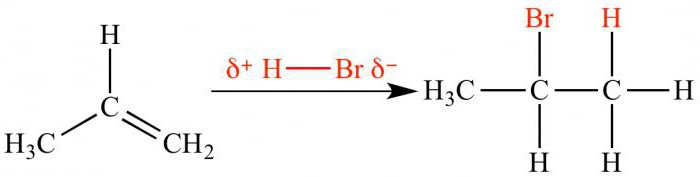
Elektrofiiliset lisäysreaktiotVetyhalogenidit ja rikkihappo menevät eri tavoin. Happamassa väliaineessa reagenssi hajoaa kationiksi ja anioniksi. Positiivisesti varautunut ioni (elektrofiili) hyökkää π-sidokseen, yhdistyy yhteen hiiliatomista. Karbokointimuodot, joissa naapurihiiliatomi varautuu positiivisesti. Lisäksi karbokiointi reagoi anionin kanssa lopullisen reaktiotuotteen muodostamiseksi.
Asymmetristen reagenssien ja Markovnikov-säännön välisen reaktion suunta

Elektrofiilinen kiinnitys kahden välilläepäsymmetriset molekyylit toimivat regioselektiivisesti. Tämä tarkoittaa, että vain yksi kahdesta mahdollisesta isomeeristä muodostuu. Regioselektiivisyys kuvaa Markovnikov-sääntöä, jonka mukaan vety on kiinnittynyt suureen määrään muita vetyatomeja (enemmän hydrattuun) liittyneeseen hiiliatomiin.
Jotta voisimme ymmärtää tämän säännön olemuksen, meidän on muistettavaettä reaktiovirta riippuu välituotteen karbokationin stabiilisuudesta. Elektroni-luovuttaja- ja akseptorisubstituenttien vaikutusta käsiteltiin edellä. Siten bromihapon elektrofiilinen lisääminen propeeniksi johtaa 2-bromipropaanin muodostumiseen. Keskiaktiivinen kationi, jolla on positiivinen varaus keskus- hiiliatomissa, on stabiilimpi kuin karbokiointi, jossa positiivinen varaus ääripäässä. Tämän seurauksena bromiatomi vuorovaikuttaa toisen hiiliatomin kanssa.
Elektronia vetävien substituenttien vaikutus vuorovaikutuksen kulkuun
Jos lähdemolekyyli sisältääelektroneja vetävällä substituentilla, jolla on negatiivinen induktiivinen ja / tai mesomeerinen vaikutus, elektrofiilinen kiinnitys menee edellä kuvattuun sääntöön. Esimerkkejä tällaisista substituenteista ovat CF3, COOH, CN. Tällöin positiivisen varauksen suuri etäisyys elektronin poistavasta ryhmästä tekee primaarisesta karbokaa- tiosta entistä vakaan. Tämän seurauksena vety yhdistyvät vähemmän hydratun hiiliatomin kanssa.
Universal-versio sääntöjen näyttää tältä: vuorovaikutus epäsymmetrisen alkeenin ja epäsymmetrinen reagenssin reaktio etenee tavalla muodostumisen vakain hiilikationin.